СЕЛЕКЦИЯ КЛЕВЕРА ЛУГОВОГО (КЛЕВЕРА КРАСНОГО)
НА ПОВЫШЕНИЕ АЗОТФИКСИРУЮЩЕЙ СПОСОБНОСТИ
Л. В. Дробышева, Г. П. Зятчина
Всероссийский научно-исследовательский институт
кормов имени
В. Р. Вильямса Российской академии
сельскохозяйственных наук, Россия
Бобовые кормовые культуры являются ценнейшими
источниками растительного белка. Высокая белковая продуктивность ставит их в
ряд наиболее предпочтительного сырья для производства кормов, отличающихся сбалансированным
содержанием питательных веществ и, в частности, аминокислот.
Важнейшее свойство бобовых культур — фиксировать
атмосферный азот — обусловлено тесным взаимодействием бобового растительного
компонента и клубеньковых бактерий, т. е. образованием эффективного бобово-ризобиального
симбиоза.
Применение штаммов клубеньковых бактерий нового
поколения позволяет повысить уровень симбиотической азотфиксации у клевера и
люцерны до 400–600 кг/га (Кожемяков, 2005).
Мобилизация биологических резервов культурных растений
способствует дальнейшему развитию селекции и, в первую очередь, это относится к
симбиотической селекции бобовых на повышение эффективности их симбиоза с
клубеньковыми бактериями (Шамсутдинов, 2004).
Известно, что бобово-ризобиальный симбиоз — это
следствие эволюционной деятельности бобовых растений и клубеньковых бактерий,
результат сопряженного естественного отбора в процессе их исторического
развития. Высокая степень наследуемости симбиотических признаков и прямая связь
между азотфиксирующей активностью и урожайностью растений свидетельствуют в
пользу результативности симбиотической селекции. Увеличение эффективности
симбиоза может быть достигнуто при создании комплементарных сочетаний генотипов
партнеров посредством их координированной селекции (Тихонович, Круглов, 2005).
Долгое время работы по повышению эффективности
растительно-микробных симбиозов являлись монополией микробиологов. Во многих
научных учреждениях были собраны обширные коллекции симбиотических
микроорганизмов, разработаны способы их выделения и хранения, созданы
технологии производства биопрепаратов и их использования. Однако эти работы
проводились изолированно от генетического анализа и селекции растений. В
результате этого роль растения-хозяина в формировании симбиозов недооценивалась,
и направленная селекция растений на повышение отзывчивости на инокуляцию не
проводилась.
На основании проведенных экспериментальных
исследований было сделано заключение, что эффективность симбиоза не является
функцией только растительного или микробного генотипов. Характер взаимодействия
зависит от совместимости генов партнеров, поэтому селекция на повышение
симбиотической эффективности должна быть направлена на создание
высококомплементарных комбинаций генотипов макро- и микросимбионтов. Из этого
следует важный вывод о том, что для существенного повышения интенсивности
азотфиксации необходимо сделать объектом селекционной работы симбиотическую
систему как единое целое (Тихонович, 1999).
Создание экологически пластичных сорто-микробных
систем позволяет наиболее полно использовать потенциал бобового растения.
Нашими исследованиями установлено, что в экстремальных природных условиях такие
системы находятся в меньшей зависимости от стресс-фактора.
Для достижения этой цели была разработана схема селекционного
процесса создания симбиотических систем, отличающихся высокой и сравнительно
стабильной азотфиксирующей способностью (рис. 1).
Согласно данной схеме, на первом этапе проводится
выделение чистых культур местных штаммов клубеньковых бактерий из аборигенной
почвенной микрофлоры. Этот процесс может осуществляться разными способами:
непосредственно из клубеньков наиболее мощных, хорошо развитых растений клевера
лугового культурных сортов и дикорастущих популяций, на корнях которых
сформировалось большое количество жизнеспособных, крупных, розовых клубеньков в
фазу «бутонизация — начало цветения», и произрастающих на почвах, контрастных
по плодородию и кислотности.
Другой способ, приобретающий все большее
распространение, — заражение почвенной суспензией в условиях стерильного
микровегетационного опыта. Его преимущество, по сравнению с традиционным, состоит
в том, что генотип клевера (какой-то конкретный сорт) уже на первом этапе
подбирает для себя комплементарный штамм.
Выделенные штаммы проходят предварительную оценку и
отбор на эффективность симбиоза по методике ВНИИСХ микробиологии в модификации
ВНИИ кормов (2002), лучшие из которых затем используются для создания комплементарных
пар.
При выращивании клевера лугового на землях с
повышенной кислотностью (рН менее 5,0), которые в Нечерноземной зоне занимают
значительные посевные площади, отмечается низкая активность
бобово-ризобиального комплекса, обусловленная токсическим действием ионов
алюминия и водорода и отсутствием эффективной аборигенной микрофлоры. Имеющиеся
коммерческие штаммы Rh. trifolii подчас не отве чают этим требованиям, что и
приводит к почти полному прекращению симбиотической азотфиксации на кислых
почвах. Методика создания исходного селекционного материала клевера лугового с
повышенной азотфиксацией для кислых почв отличается некоторыми особенностями,
позволяющими обеспечивать эффективную деятельность бобово-ризобиального
комплекса в условиях повышенной кислотности.
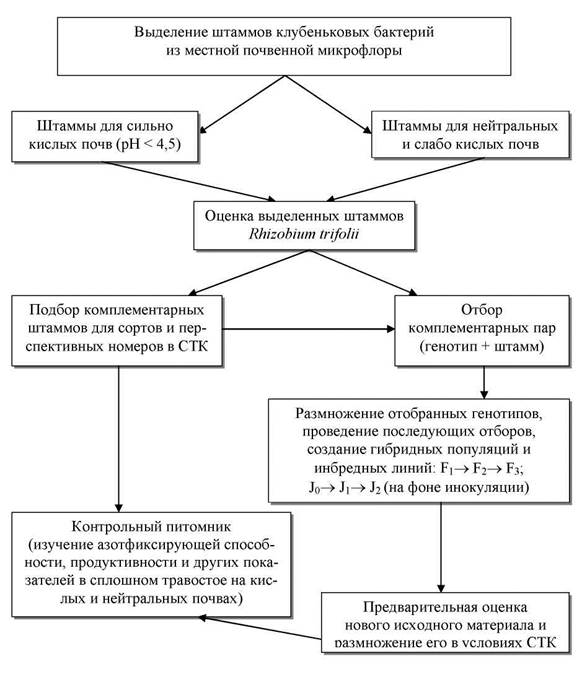
Рис. 1. Схема
создания исходного материала клевера лугового на повышение симбиотической
азотфиксации
Моделирование условий проведения экспериментов при
высокой кислотности почвы, обусловленной повышенным содержанием ионов водорода
и алюминия, требует особого подхода. Для решения этой задачи во ВНИИ кормов был
разработан «Способ отбора штаммов Rhizobium trifolii, способных к
эффективному симбиозу на кислых почвах с повышенным содержанием ионов
алюминия» (патент на изобретение № 22005215, 2003). Суть метода заключается в
подборе питательных сред для создания экстремальных условий при культивировании
Rh. trifolii и
выращивании растений клевера лугового (повышенной кислотности). С этой целью в
среду вносили Al3+, на которой затем
выращивали Rh. trifolii в чистой культуре (на агаровой среде) и в симбиозе с
растениями клевера лугового (на водной среде).
Способ состоит из двух этапов: на первом этапе
проводится предварительный отбор кислотоустойчивых штаммов клубеньковых бактерий
в селективной среде. В бобовый агар после его стерилизации добавляется
хлористый алюминий (AlCl3) в различных
концентрациях. Оценка штаммов на кислотоустойчивость осуществляется по пятибалльной
шкале через трое суток после посева. В качестве контроля используются
клубеньковые бактерии, посеянные на бобовом агаре без Al3+.
В опыте оценивались новые штаммы, выделенные из местной почвенной микрофлоры (табл.
1).
1. Оценка штаммов Rh. trifolii на
жизнеспособность в кислой среде с повышенным содержанием ионов Al3+ (балл)
|
Штамм
|
Контроль
(без Al 3+)
|
Концентрация Al 3+
|
|
50 мг/л (рН 5,0)
|
75 мг/л (рН 4,5)
|
100 мг/л (рН 4,1)
|
|
КС-1
|
5,0
|
3,0
|
0
|
0
|
|
КС-2
|
5,0
|
4,5
|
0
|
0
|
|
КС-4
|
5,0
|
4,8
|
4,5
|
0
|
|
КС-5
|
5,0
|
4,3
|
2,5
|
0
|
|
КС-6
|
5,0
|
4,5
|
0,5
|
0
|
|
КС-7
|
5,0
|
5,0
|
1,0
|
0
|
|
КС-9
|
5,0
|
4,0
|
1,0
|
0
|
|
КС-10
|
5,0
|
4,8
|
4,0
|
0
|
|
КС-13
|
5,0
|
4,8
|
0
|
0
|
|
КС-16
|
5,0
|
4,5
|
2,5
|
0
|
|
КС-18
|
5,0
|
4,5
|
4,0
|
0
|
|
КР-2
|
5,0
|
4,0
|
0,5
|
0
|
|
КР-2а
|
5,0
|
3,5
|
0
|
0
|
|
КР-4
|
5,0
|
5,0
|
0
|
0
|
|
КР-5
|
5,0
|
2,5
|
1,5
|
0
|
|
КР-8
|
5,0
|
4,5
|
4,0
|
0
|
|
348а
|
5,0
|
5,0
|
4,5
|
0
|
Из таблицы видно, что большее число штаммов (более 70 %)
способно сохранять жизнеспособность в сильнокислой среде (рН 4,5). Концентрация
ионов AI3+ в 100 мг/л оказалась губительна
для всех изучаемых штаммов клубеньковых бактерий. Результаты эксперимента показали,
что отбор кислотоустойчивых штаммов Rh. trifolii целесообразно проводить на бобовой питательной
среде с добавлением 75 мг/л Al3+.
Отбор штаммов на эффективность симбиоза с клевером
луговым проводится в микровегетационном опыте по методике ВНИИСХ микробиологии
в модификации ВНИИ кормов. Растения выращиваются в пробирках емкостью 50
мл, наполненных вермикулитом. В питательную безазотистую среду
Красильникова-Кореняко вносятся ионы Al3+ в форме
AlCl3 в концентрации 50 мг/л раствора, рН
которого должно составлять 4,5.
Далее селекционная работа на увеличение
азотфиксирующей способности клевера идет в двух направлениях: подбор
комплементарных штаммов к уже имеющимся сортам и перспективным номерам клевера
лугового и создание нового селекционного материала на основе отобранных
симбиотических систем «генотип + штамм».